TOMID张超/宋剑/蒲建 | AHM:炎症环境下金属生物材料摩擦腐蚀研究进展
金属生物材料广泛应用于骨科、牙科及心血管等医疗植入领域,然而,摩擦腐蚀——即机械磨损与电化学腐蚀的协同作用——已成为限制其长期服役性能的关键瓶颈。在炎症微环境中,这一问题尤为突出,不仅导致植入体失效,更可能引发局部组织炎症、骨质溶解甚至系统性健康风险。近日,中山大学生物医学工程学院张超/宋剑/蒲建课题组系统综述并揭示了在模拟炎症条件下金属生物材料的摩擦腐蚀行为与机制,提出了材料降解与免疫反应之间的“双向交互作用”机制,为开发耐摩擦腐蚀的新型金属植入体提供了重要理论依据。

论文指出,传统观点认为植入体释放的金属离子和磨损颗粒会引发炎症反应;而近年来发现,炎症细胞(如巨噬细胞和中性粒细胞)会主动附着于植入体表面,释放活性氧(ROS)和酸性物质等炎症物质,进一步破坏金属表面的钝化膜,加速材料降解。这一“材料降解—细胞激活—微环境调控”的恶性循环,成为植入体在炎症环境中早期失效的核心机制。
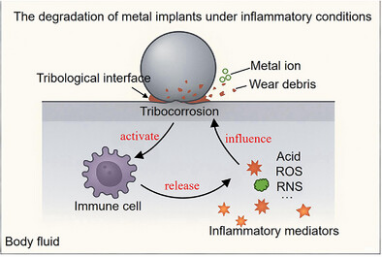
团队系统总结了在含炎症介质(如H₂O₂、HClO、乳酸等)电解液及与免疫细胞共培养条件下,钛合金、钴铬钼合金等常用金属材料的摩擦腐蚀行为。研究发现,ROS虽加剧电化学腐蚀,但在特定条件下可促进表面多孔氧化层形成,暂时降低摩擦系数;而酸性环境则显著削弱钝化膜稳定性,加剧材料损失。
为进一步提升金属植入体在炎症环境中的服役性能,研究团队提出了多种应对策略,包括合金设计(如添加钼元素)、表面改性(如石墨烯-透明质酸复合涂层)及先进制造技术(如激光增材制造)。特别是具有免疫调节功能的生物活性涂层,不仅能减少磨损与离子释放,还可调控巨噬细胞极化行为,缓解炎症反应,促进骨整合。
该成果以《Tribocorrosion of Metallic Biomaterials under Simulated Inflammation Conditions: Current Status and Future Prospects》为题,发表于生物医学工程领域知名期刊《Advanced Healthcare Materials》。中山大学生物医学工程学院的蒲建博士后为论文第一作者,宋剑副教授为通讯作者,张超教授为共同作者,中山大学生物医学工程学院为第一完成单位。
该研究得到了广东省基础与应用基础研究基金(2025A1515012203、2023A1515110565)和深圳市科技计划(JCYJ20240813151307010)的资助。
论文链接:Jian Pu, Chenxuan Liu, Yunhui Si, Wen Cui, Chao Zhang, Jian Song,Tribocorrosion of Metallic Biomaterials under Simulated Inflammation Conditions: Current Status and Future Prospects,Advanced Healthcare Materials,2025, e02419, https://doi.org/10.1002/adhm.202502419.
供稿:蒲建
终审:宋剑

