Bioactive Materials | TOMID团队张超课题组在水凝胶支架封装MSC-Exos与ZIF-8以协同成骨与免疫调节促进骨再生方面发表论文
近日,中山大学生物医学工程学院张超教授课题组开发了一种结合骨功能化间充质干细胞外泌体(MSC-Exos)与ZIF-8修饰GelMA水凝胶的复合支架(MSC-Exos/ZIF-8@GelMA),通过外泌体microRNA-23a-3p激活AKT信号通路促进成骨及ZIF-8抑制NF-κB通路诱导免疫调节,协同增强骨再生、血管生成并降低炎症水平,为临界尺寸骨缺损修复提供了兼具成骨与免疫调节功能的新型组织工程策略。相关工作以“Hydrogel scaffold encapsulating MSC-Exos and ZIF-8 promotes bone regeneration via coordinating osteogenesis and immunomodulation”为题发表于著名期刊Bioactive Materials(生物材料领域排名第一)。

骨组织修复面临重大挑战,尤其是临界尺寸骨缺损的再生受限和免疫微环境失衡问题。传统自体骨移植存在供体有限和二次创伤等缺点,而人工骨材料则在免疫相容性和功能协同性方面仍有不足。MSC-Exos虽具有优异的成骨诱导潜力,但其免疫调节功能在成骨分化过程中显著下降。金属有机框架材料(MOFs)如沸石咪唑酯骨架-8(ZIF-8)在骨组织工程中展现出了独特的免疫调节特性,但其中的分子机制尚不明确。
针对这一科学难题,张超教授团队通过超速离心从成骨预分化的骨髓间充质干细胞(BMSCs)中分离MSC-Exos,并将其封装于含骨免疫调节剂ZIF-8的GelMA水凝胶中,构建了兼具成骨促进与免疫调节功能的复合生物支架(图2, 3)。该支架通过释放的外泌体中miRNA-23a-3p激活BMSCs的AKT信号通路,上调成骨相关蛋白表达并加速细胞外基质矿化(图4);同时ZIF-8通过抑制炎症刺激下RAW264.7细胞中非经典NF-κB通路的激活,诱导巨噬细胞向抗炎M2型极化,显著降低炎症反应(图5)。在大鼠颅骨缺损模型中,复合支架表现出优异的骨诱导特性与抗炎能力,加速新骨形成及血管生成(图6)。本研究不仅阐明了外泌体miRNA的成骨调控机制,还揭示了ZIF-8作为免疫调节剂的分子作用,为骨组织工程支架的设计提供了将外泌体与免疫调节剂整合的创新策略。

图1. 用于骨缺损协同治疗的复合水凝胶支架示意图
本研究创新性地将成骨诱导的MSC-Exos与ZIF-8整合,首次揭示ZIF-8通过抑制P100(K332/K338)泛素化调控NF-κB通路的分子机制,同时阐明miR-23a-3p/PTEN/AKT轴在外泌体介导的成骨分化中的核心作用。这种“双信号”调控策略为设计具有免疫调节功能的骨修复材料提供了新思路,解决了传统支架材料“重成骨轻免疫”的瓶颈问题。研究采用的GelMA水凝胶具有良好的临床转化前景,其温和的光交联条件有利于保持生物活性物质的效能。未来可通过微流控技术制备可注射型水凝胶微球,进一步拓展在该体系在复杂骨缺损中的应用。
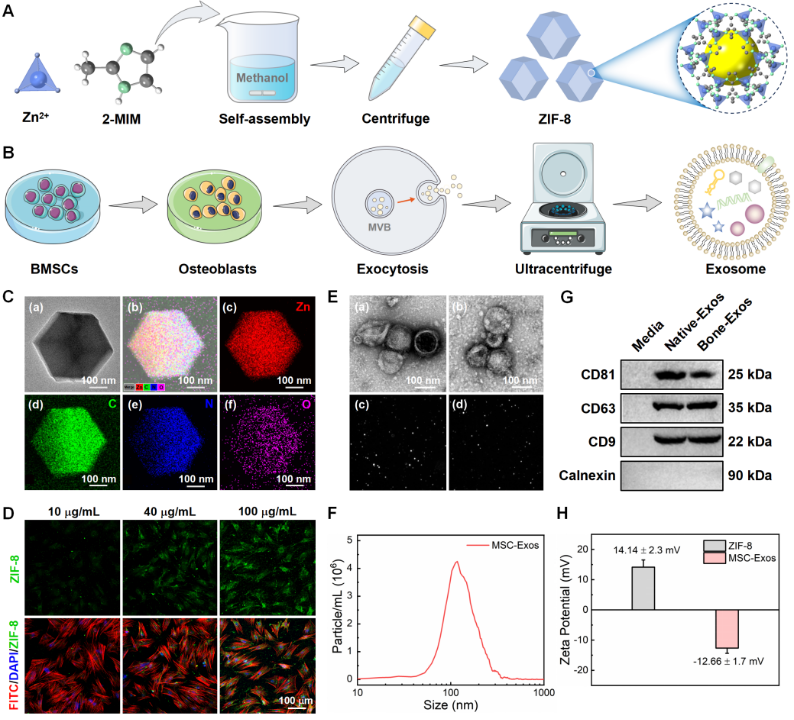
图2. ZIF-8纳米颗粒的制备和MSC-Exos的分离程序

图3. 复合水凝胶的制备及生物相容性评价

图4. MSC-Exos诱导BMSCs成骨分化的分子机制

图5. ZIF-8在免疫调节中的分子机制

图6. 复合水凝胶支架在体内骨形成性能的评估
中山大学生物医学工程学院博士后司云晖为论文第一作者,中山大学张超教授为论文最后通讯作者,深圳市药品检验研究院王书晗主任为论文共同通讯作者。论文作者还包括中山大学硕士生董树澳和硕士生高雪琴等。本研究得到了国家自然科学基金(资助号:81971760)和广州市重点研发计划(资助号:202206010115)的资助。
原文链接:https://doi.org/10.1016/j.bioactmat.2025.08.026
供稿:司云晖
终审:张超

