Bioactive Materials | TOMID王佳力课题组在镁离子促巨噬细胞分泌前列腺素E2以调节成纤维细胞向肌成纤维细胞的逆转分化,抑制移植物纤维化方面发表论文
近日,中山大学王佳力课题组发现ACL重建后肌腱移植物中段由于胶原纤维的表型变化及排列异常,并伴随TGF-β1上调诱导的成纤维细胞分化为肌成纤维细胞从而导致纤维化这一现象。该课题组巧妙利用镁离子能干预巨噬细胞释放更多的PGE2,经由PGE2调节成纤维细胞向肌成纤维细胞的逆转分化以介导瘢痕纤维化的减少,同时加速肌腱韧带化的进程。相关工作以“Magnesium ions attenuate tendon graft fibrosis during its ligamentization after ACL reconstruction through modulation of fibroblast to myofibroblast trans-differentiation by promoting PGE2 secretion.”为题发表于著名期刊Bioactive Materials(生物材料领域排名第一)。

前交叉韧带(ACL)重建中,肌腱移植物的韧带化过程对移植物愈合质量及膝关节功能至关重要。成纤维细胞向肌成纤维细胞分化激活引起的移植物中段过度瘢痕化会严重损害韧带化进程,其特征是胶原纤维排列紊乱且成分异常。阐明移植物纤维化的潜在机制有助于调控肌腱移植物的韧带化。本研究发现,在韧带化过程中转化生长因子β1(TGF-β1)显著上调,其促进成纤维细胞向肌成纤维细胞分化,进而导致胶原排列紊乱并过度产生III型胶原。值得注意的是巨噬细胞分泌的主要炎症介质前列腺素E2 (PGE2)可显著逆转TGF-β1诱导的成纤维细胞向肌成纤维细胞的逆转分化。此外,镁离子 (Mg²⁺)被发现能上调巨噬细胞中PGE2的产生,最终抑制瘢痕组织形成,并在大鼠模型中促进移植物中段表达韧带样表型。动物实验结果表明,向膝关节腔注射含镁离子的海藻酸钠溶液的大鼠,其步态表现和移植物最大负荷较对照组显著改善。这些结果证实了使用镁离子调控ACL重建术后患者肌腱韧带化的可行性(机制图如图1)。
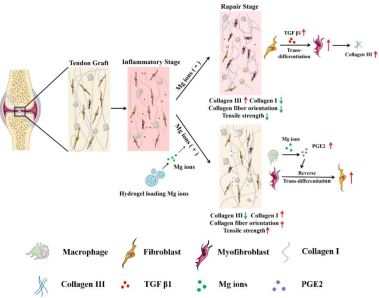
图1 肌腱移植中物质韧带化过程中的纤维化机制及修复策略。在因失神经和失血管而受损的自体肌腱移植物中,坏死的成纤维细胞产生TGF-β1,从而诱导邻近成纤维细胞向肌成纤维细胞转化,产生大量三型胶原,引起肌腱移植物纤维化。镁离子通过促进巨噬细胞分泌PGE2有效减轻肌腱移植中间部分的纤维化,有助于肌成纤维细胞向成纤维细胞的逆转分化。
一、大鼠前交叉韧带重建后韧带化过程伴随肌腱移植物早期愈合阶段的功能受损
韧带化过程可分为三个主要阶段:炎症期(早期愈合阶段)、增生期和重塑期。各阶段细胞活性存在显著差异。如图2所示,术后2周肌腱移植物细胞密度开始增加,4周达到峰值,而8周时出现下降,表明4周是增生期胶原合成的关键时间节点。此外,步态实验和肌腱移植物力学测试表明术后早期愈合阶段肌腱移植物的功能受损。
胶原纤维在肌腱移植物中的组织结构密切影响其功能,因此我们对肌腱移植物胶原组成和结构随时间的变化进行表征。如图3-4显示术后早期(2 - 4周)肌腱移植物经历胶原重构过程:胶原I α1(COL1A1)蛋白水平显著降低,而胶原III α1(COL3A1)蛋白水平显著升高,证实了韧带化过程中I型与III型胶原的比例失衡。III型胶原占比升高,导致胶原原纤维直径分布中较细的部分比例增大,加速纤维排列紊乱,共同造成该阶段移植物力学性能显著降低。进一步排除异位骨化的可能性,并通过对肌腱特异性标志物鉴定,表明术后4周可能是肌腱移植物韧带化进程启动的关键节点。
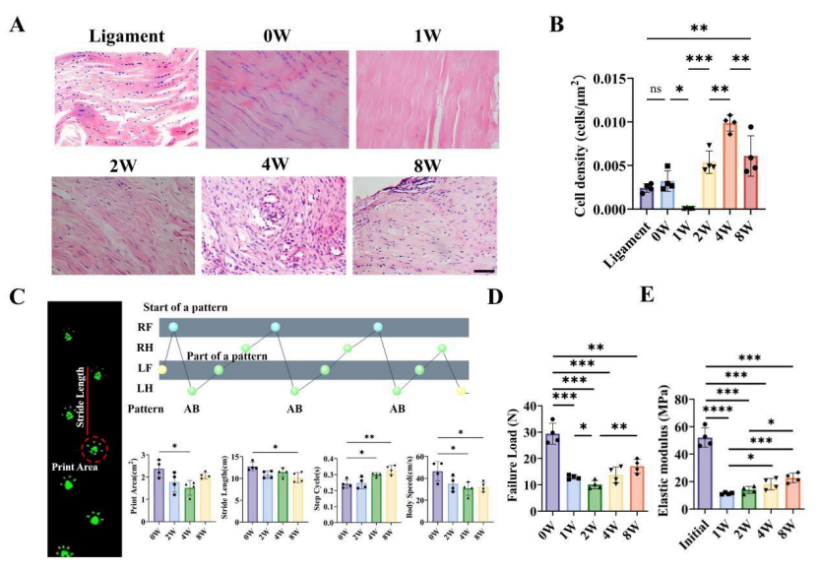
图2 大鼠前交叉韧带重建后肌腱移植物组织学和功能随时间的变化。

图3 大鼠前交叉韧带重建后肌腱移植物胶原组成和结构随时间的变化。
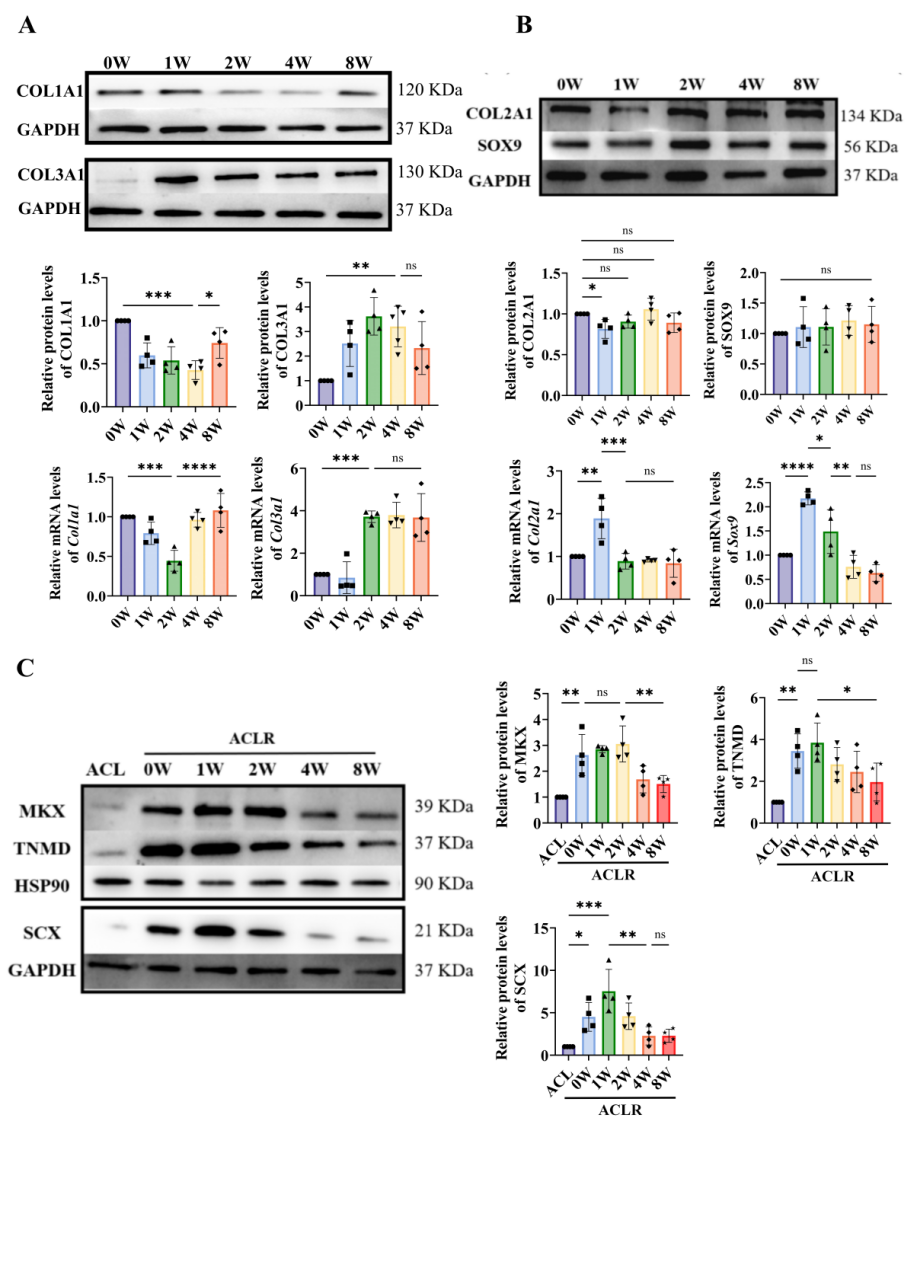
图4大鼠前交叉韧带重建后肌腱移植物相关蛋白和mRNA表达水平随愈合时间的变化。
二、PGE2可逆转TGF-β1诱导的成纤维细胞向肌成纤维细胞的分化,减少瘢痕组织III型胶原的生成
III型胶原是存在于肌腱瘢痕组织中的一种蛋白,而TGF-β1是影响肌腱愈合、瘢痕形成和胶原生成的细胞因子。如图5所示TGF-β1与α-平滑肌肌动蛋白(α-SMA)在愈合期显著升高,表明TGF-β1可能是促移植物瘢痕组织合成III型胶原的关键诱因。
为探究TGF-β1对瘢痕形成的影响,我们通过体外实验阐明肌腱源成纤维细胞的分化。如图6所示:在细胞培养基中添加TGF-β1后,α-SMA、COL1A1和COL3A1的基因与蛋白表达均显著升高,证明TGF-β1促进了成纤维细胞向肌成纤维细胞的分化。进一步验证PGE2对TGF-β1预处理的肌腱细胞的影响。结果显示PGE2显著逆转TGF-β1诱导的α-SMA和COL3A1上调,同时通过抑制COL1A1产生拮抗TGF-β1的促纤维化作用。值得注意的是,细胞经TGF-β1诱导后加入PGE2,可促使肌成纤维细胞逆转为成纤维细胞;当再次添加TGF-β1又能重启逆转分化过程(图7)表明TGF-β1与PGE2是调控二者逆转分化平衡的关键因子。需强调的是,尽管PGE2对逆转分化具有正向调节作用,但长期高剂量使用可能对肌腱移植物纤维化产生双重影响(图8-9),提示直接释放PGE2在韧带化过程中存在潜在风险。
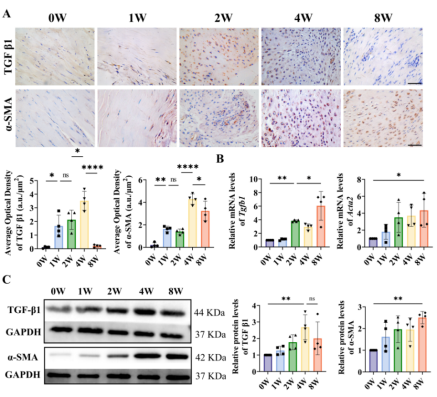
图5 TGF-β1和α-SMA在肌腱移植物中的表达水平随时间的变化。
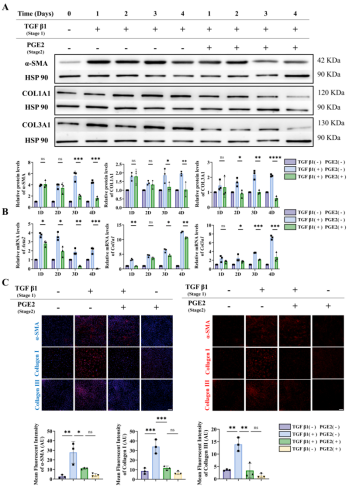
图6 TGF-β1和PGE2对肌腱源性成纤维细胞α-SMA、COL1A1和COL3A1表达水平的影响。
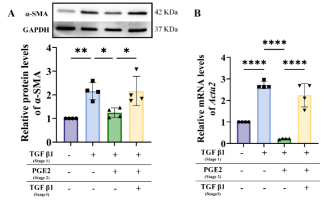
图7 TGF-β1与PGE2共同调控成纤维细胞与肌成纤维细胞逆转分化的平衡。
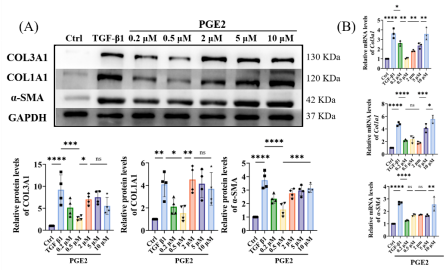
图8 PGE2浓度对成纤维细胞向肌成纤维细胞转分化的影响。
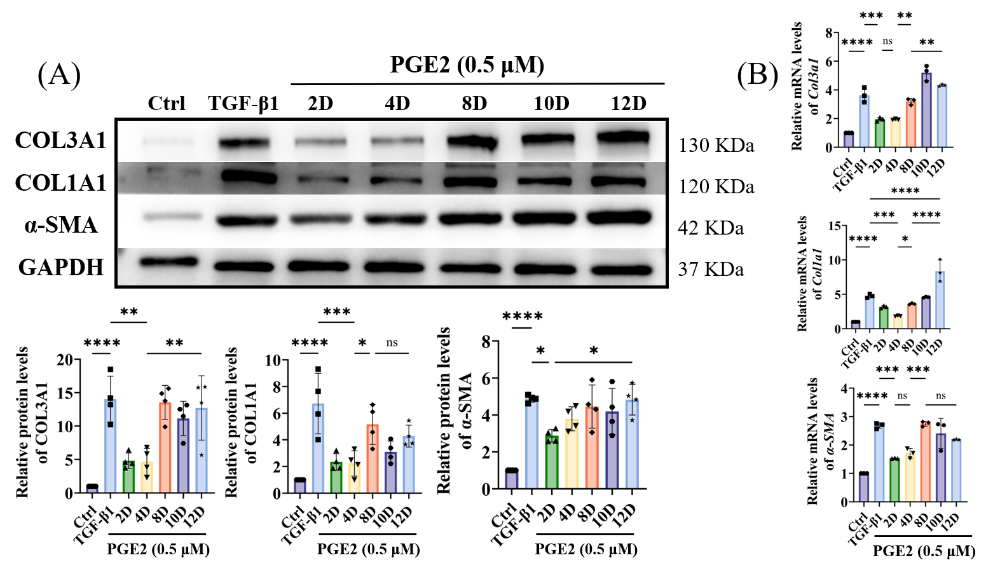
图9 PGE2诱导时间对成纤维细胞向肌成纤维细胞逆转分化的影响。
三、镁离子可刺激巨噬细胞释放PGE2以抑制TGF-β1诱导的肌腱移植纤维化
成骨细胞与巨噬细胞已被证实是分泌PGE2的主要细胞来源。近期研究发现二价阳离子可引发PGE2介导的骨骼内感受,提示其可能诱导肌腱移植物中巨噬细胞分泌PGE2,从而缓解TGF-β1介导的纤维化。因此本研究采用镁离子处理巨噬细胞检测PGE2分泌。如图10结果显示镁离子显著上调环氧化酶2(COX2,PGE2合成关键酶)蛋白表达。随后,在体外经过镁离子处理过的巨噬细胞条件培养基具有逆转分化的能力。值得注意的是,Mg离子的添加在2 d内对分化相关蛋白表达水平无显著影响,随着处理时间超过3天,蛋白的表达水平显著上调。
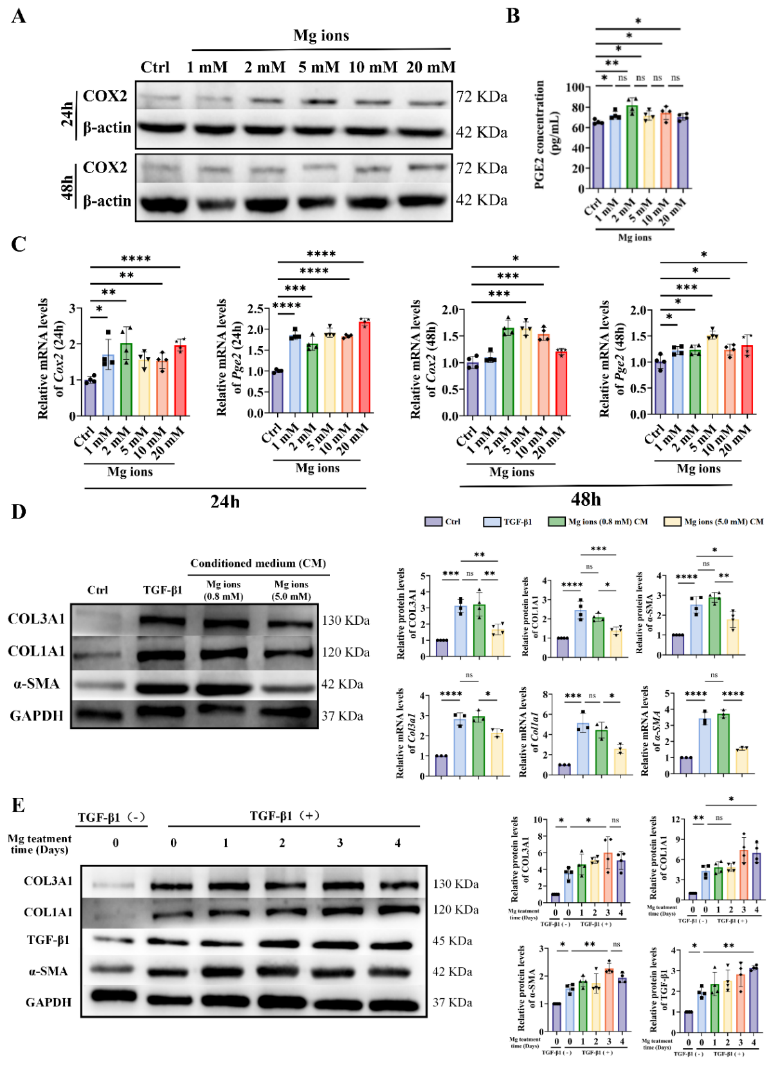
图10 Mg离子对RAW264.7细胞PGE2生成及TGF-β1诱导纤维化的影响。
为明确镁离子对PGE2表达的影响,本研究增设镁离子缺乏组,如图11所示巨噬细胞释放PGE2具有镁离子浓度依赖性。同时检测了肌腱移植物内巨噬细胞数量的影响,术后1周移植物巨噬细胞数量较术前显著增加(图12),但1周后无显著变化,提示促炎/抗炎巨噬细胞在移植物愈合中的关键作用。值得注意的是,镁离子干预对术后4周及8周的巨噬细胞数量均无显著影响。在明确镁离子抑制TGF-β1诱导纤维化的基础上,我们检测其对TGF-β1表达的影响,结果(图13)显示镁离子的抗纤维化作用不依赖TGF-β1剂量。为探究镁离子对TGF-β1信号通路的调控,实验对TGF-β1预处理的肌腱成纤维细胞添加镁离子。图14显示镁离子可能通过不依赖TGF-β/SMAD信号通路的方式间接发挥抗纤维化作用。
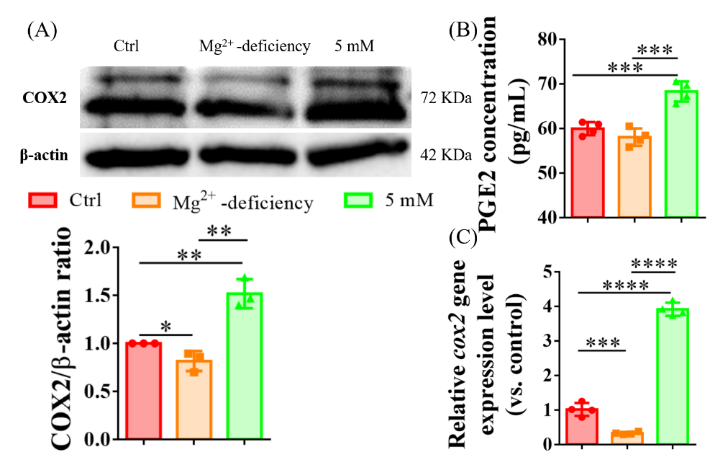
图11 不同浓度Mg离子处理48 h后对肌腱源性成纤维细胞COX2/PGE2表达水平影响。

图12 免疫组织化学染色定量分析肌腱移植物中的巨噬细胞。
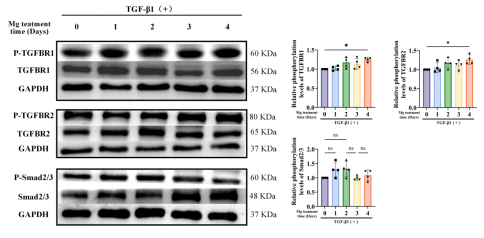
图13 Mg离子对TGF-β1信号通路的影响。
我们制备了一种含镁离子的海藻酸钠水凝胶通过关节腔注射的方式注入大鼠膝关节,以介导肌腱移植物的抗纤维化。如图14显示水凝胶在大鼠体内留存7天并释放大多数镁离子。图14-15显示镁离子处理组移植物胶原区域显著扩大且III型胶原占比降低,胶原原纤维直径显著上升。分子机制验证表明:含镁水凝胶显著降低α-SMA与COL3A1表达,同时提升PGE2水平。针对韧带和肌腱标志基因的实验结果显示镁离子促进了肌腱移植物韧带化水平,但对MKX与TNMD等肌腱特异性蛋白表达未显著改变,表明镁离子通过间接调控成纤维细胞逆转分化发挥作用,而不影响干细胞肌腱分化进程。宏观上如图16显示经含镁水凝胶治疗后的大鼠膝关节功能水平和肌腱移植物的力学性质较治疗前都有显著改善。
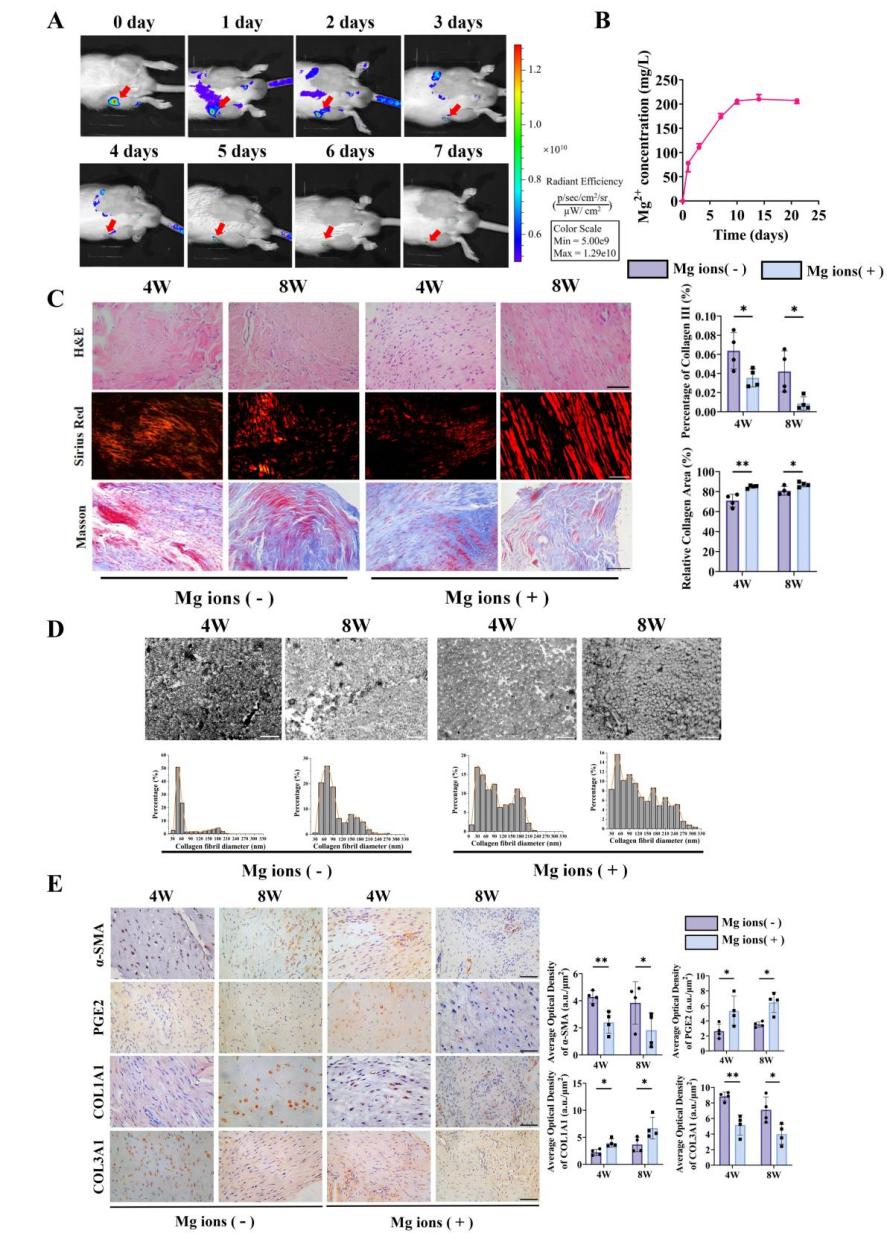
图14 组织学分析研究镁离子处理对大鼠前交叉韧带重建术后肌腱移植物韧带化的影响。

图15 基因和蛋白水平的定量分析探讨镁离子处理对大鼠肌腱重建后韧带化的影响。
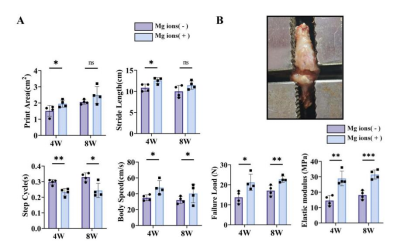
图16 镁离子处理对前交叉韧带重建大鼠膝关节功能的影响。
综上所述,ACL重建术后肌腱移植物经韧带化过程,伴随胶原成分、尺寸、排列及力学强度的动态变化。本研究证实TGF-β1是影响移植物中段韧带化的核心细胞因子——通过诱导成纤维细胞向肌成纤维细胞分化,导致III型胶原过度沉积。突破性发现在于:PGE2可逆转上述分化过程,显著抑制III型胶原合成。更重要的是,二价阳离子镁离子通过促进PGE2分泌,有效抑制移植物纤维化,进而赋予移植物更接近天然韧带的表型特征,最终改善膝关节功能。这些发现为开发ACL术后肌腱移植物韧带化的治疗策略奠定了分子机制基础。
中山大学硕士生许昶昊、博士生罗颖为论文共同第一作者,中山大学王佳力教授为论文最后通讯作者,山东大学宫宁基教授、深圳市儿童医院游超副主任为论文通讯作者。本研究得到了国家自然科学基金(资助号:32271381和32471378),深圳市科学技术创新委员会(批准号:JCYJ20220530145601004),广东省基础与应用基础研究基金(批准号:2024A1515010311)、山东省医学会“2023青年精英科学家资助计划”、济南市科技计划项目(202328050)的资助。
原文链接:https://doi.org/10.1016/j.bioactmat.2025.06.019
供稿:许昶昊 罗颖
终审:王佳力

