学院新闻
我院刘杰教授团队在癌症化学免疫治疗领域取得重要进展
由于肿瘤特异性细胞毒性T淋巴细胞(CTL)浸润不足调节性T (Treg)细胞和肿瘤相关巨噬细胞(TAM)等造成的免疫抑制性肿瘤微环境(ITM),导致目前的免疫疗法应答率低。越来越多的研究证据表明,先天免疫是机体抵御感染和癌症的第一线防御机制,激活先天免疫可以缓解ITM,促进CTL浸润,增强抗肿瘤免疫应答。最近,环鸟苷单磷酸腺苷(GMP-AMP)合成酶/干扰素基因刺激因子(cGAS/STING)通路已成为增强抗肿瘤先天免疫的一种有前景的策略。研究发现,Mn2+可通过增强cGAS对胞质DNA的敏感性、促进酶活性以及增强cGAMP-STING的结合亲和力来激活cGAS/STING信号,从而促进DC成熟和抗原呈递。另外多项研究表明化疗药物引起的DNA损伤可刺激IFN分泌,并通过STING信号激活DC。结合Mn2+和DNA损伤靶向药物可能达到激活STING信号的协同作用。然而,TAM作为ITM中最丰富的肿瘤浸润免疫细胞,通常呈现为M2表型,已被证明会损害癌症免疫治疗,而M1型巨噬细胞则通过释放促炎因子直接攻击肿瘤细胞。研究表明利用CD47和M1表型外泌体促进TAM向M1表型再极化有望缓解ITM以改善癌症免疫治疗。
近日,刘杰教授团队首次提出将来自M1巨噬细胞(M1-exos)的外泌体与来自CD47过表达的基因工程化肿瘤细胞的外泌体(GT-exos)融合,设计并制备了基因工程化杂交外泌体(gHE),并进一步包裹DNA损伤化疗药物SN38和MnO2纳米颗粒(NPs)以激活STING通路实现癌症的化学免疫治疗。该工作首先证明了SN38和MnO2负载的gHE(SN/Mn@gHE)可通过CD47伪装有效逃避免疫清除,实现长循环,同时将TAM再极化为M1表型,并通过抑制来自肿瘤细胞的“不要吃我”信号促进巨噬细胞的吞噬。同时,SN/Mn@gHE通过SN38的化疗作用诱导免疫原性细胞死亡(ICD),同时产生胞质DNA,而NPs在酸性TME中分解成Mn2+,两者协同激活GAS/STING通路,促进DCs成熟、CTL浸润和NK细胞募集,同时上调了记忆T细胞的比例,有效抑制了肿瘤的生长、复发和转移。该研究通过杂交外泌体调节巨噬细胞、刺激STING途径来激活先天免疫、改善ITM从而实现抗肿瘤免疫应答,并通过动物模型证明SN/Mn@gHE治疗显著抑制了双侧肿瘤的生长,可诱导肿瘤组织明显的组织学损伤和细胞凋亡,抑制细胞增值,同时也可抑制肺部转移,具有良好的生物安全性。研究人员进一步探究了抗肿瘤免疫机制。SN/Mn@gHE可有效将TAM重编程为M1表型,通过释放促炎因子直接攻击肿瘤细胞。同时通过STING通路激活和免疫原性细胞死亡诱导DC成熟,促进NK细胞的募集,提高CTL在肿瘤部位的浸润比例,显著降低Tregs的数量,改善了肿瘤免疫抑制性的肿瘤微环境,并通过记忆T细胞诱导长期免疫效应,防止肿瘤复发。
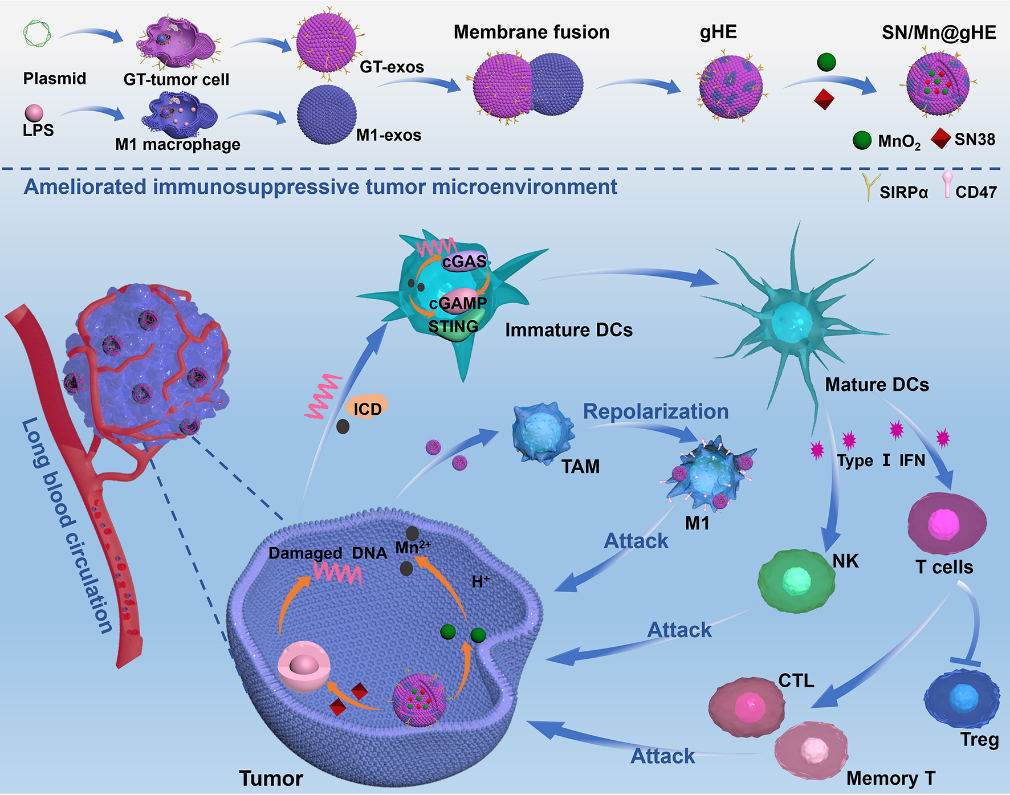
图1. SN/Mn@gHE通过调节TAM和激活cGAS/STING通路改善ITM的示意图
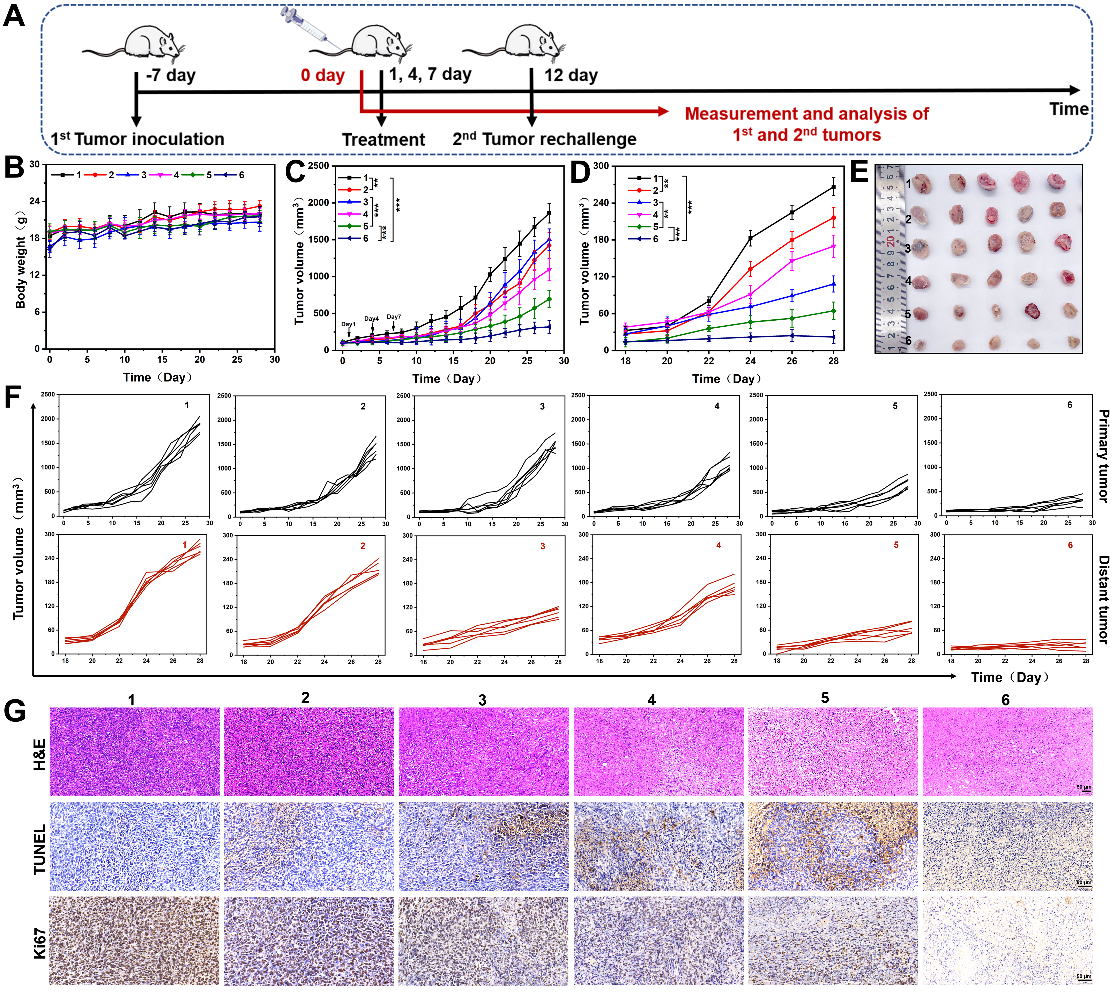
图2. SN/Mn@gHE的抗肿瘤作用。
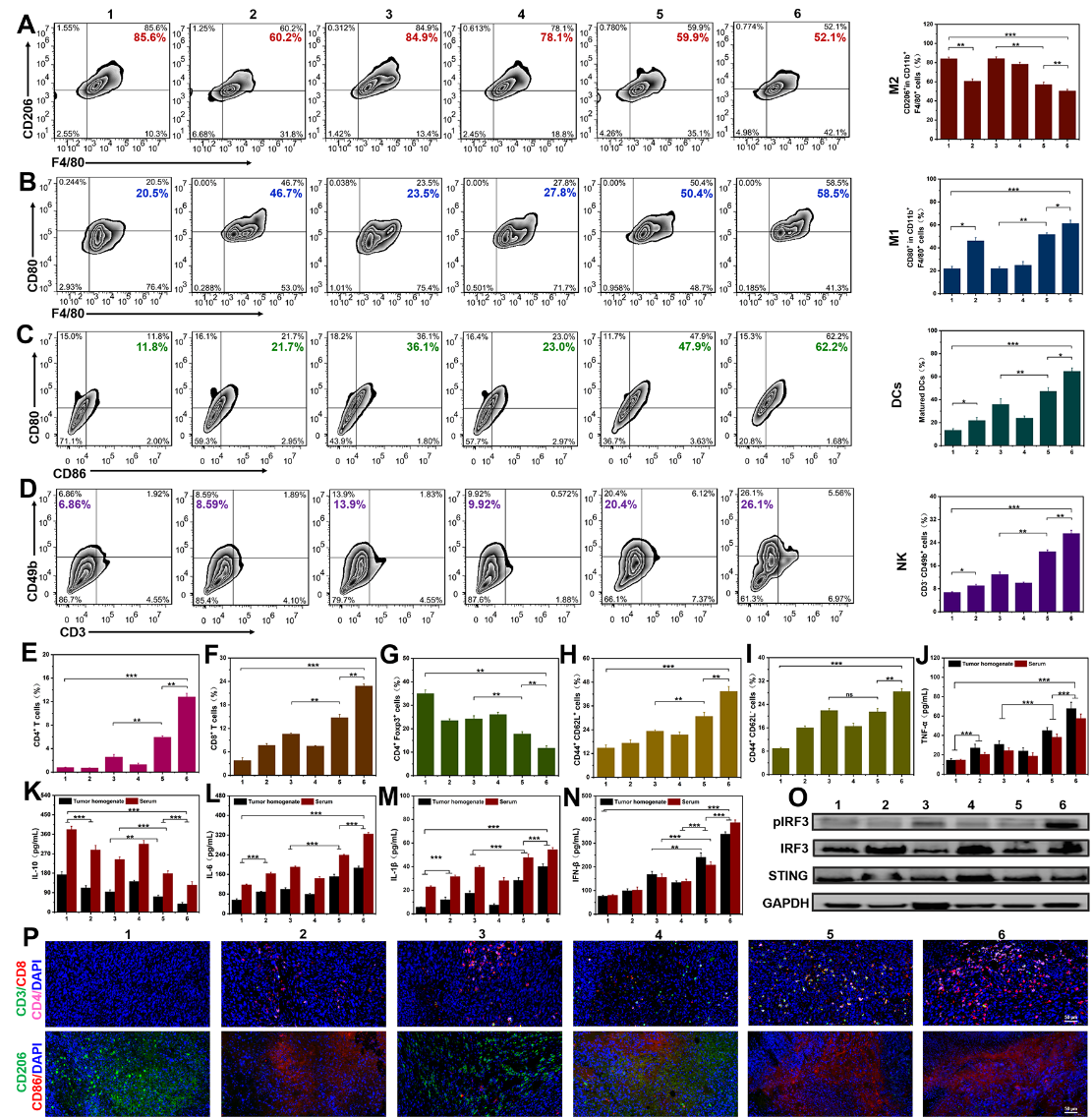
图3. 多功能杂交外泌体诱导抗肿瘤免疫应答
相关研究成果以“Multifunctional hybrid exosomes enhanced cancer chemo-immunotherapy by activating the STING pathway”发表在国际生物材料权威期刊Biomaterials。我院博士生程利利和张鹏为该论文的共同第一作者,我院刘杰教授为该论文的通讯作者,中山大学生物医学工程学院为唯一通讯单位。

