学院新闻
我院戴宗教授团队在细胞外囊泡亚群分离领域取得进展
急性细胞排斥反应(ACR)是器官移植后最常见的早期免疫排斥反应之一,是移植物衰竭和移植受者死亡的重要危险因素。当前,临床上仍缺乏用于ACR诊断的可靠的无创检测指标。细胞外囊泡(EVs)在生理过程和疾病进展中发挥着不可替代的作用,可作为疾病诊断的标志物。来自同一亲本细胞的EV亚群,其物理特性和内容物可能存在差异。目前,EV亚群的分离方法掩盖了EV表面蛋白的结构和寡聚状态等信息。为了更准确地描述T细胞来源的EV亚群在排斥反应中发挥的作用,并寻找新的ACR生物标志物,迫切需要更精确的方法来分离T细胞在不同状态下分泌的EVs。
近日,我院戴宗教授团队首次提出了一种基于核酸适配体修饰纳米金的卡尺策略。以两个CD3适配体构建具有优化间距的卡尺探针,并组装在纳米金上形成Au-Caliper纳米平台(图1)。构建小鼠ACR模型,从小鼠血浆中成功分离得到两个T细胞来源的EV亚群。对亚群进行表型鉴定和测序分析表明:TCR-CD3二聚体EVs的CD3表达量更多,颗粒尺寸更大;TCR-CD3单体EVs表达上调的11个microRNAs中,有7个被报道在发生ACR的患者中与免疫激活和促进炎症反应相关,其靶基因在T细胞激活和免疫系统的细胞因子信号中显著富集(图2)。结果显示TCR-CD3单体EVs有望成为ACR潜在的无创检测标志物。该卡尺策略为解构EV亚群的异质性开辟了新方向,有望通过改变卡尺探针的序列和间距应用于更广泛的蛋白质异构EV亚群研究。
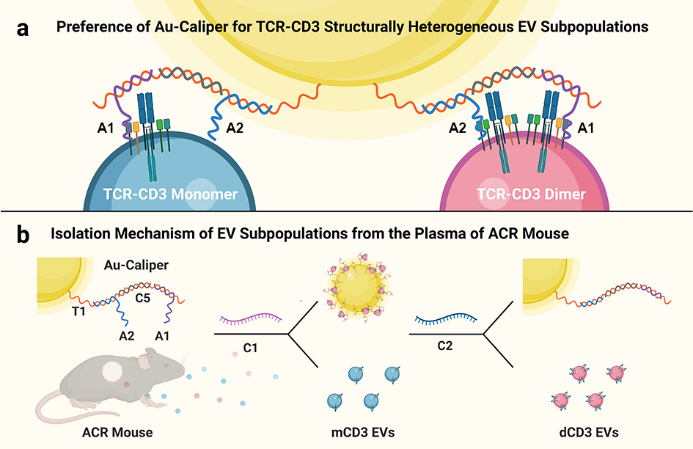
图1. (a) Au-Caliper的结构示意图,以及卡尺探针与TCR-CD3单体和二聚体的结合偏好性;(b) 结构异质性TCR-CD3 EV亚群的分离机制。
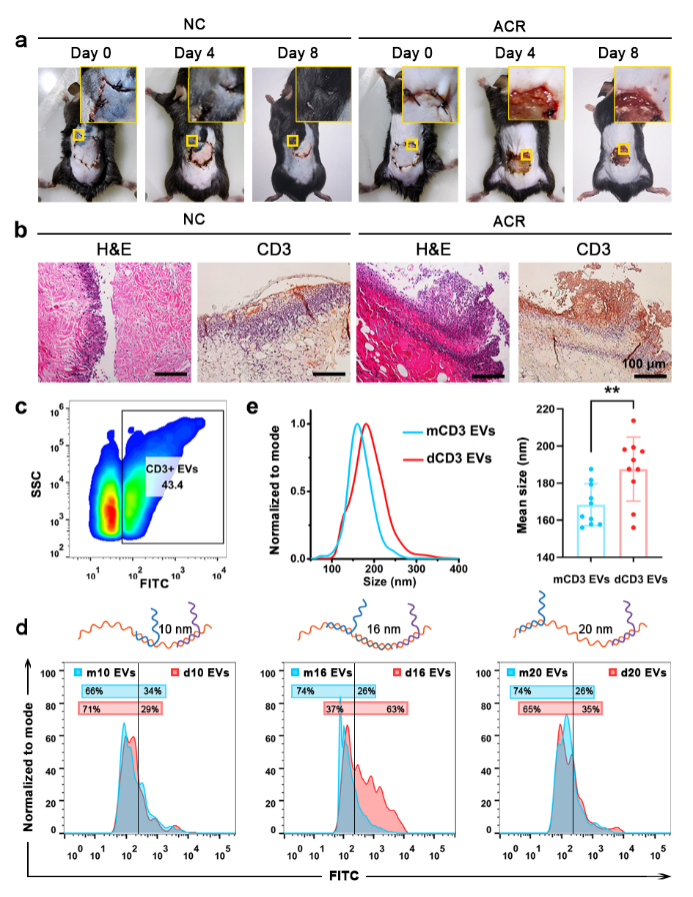
图2. ACR小鼠血浆中EV亚群的表型差异分析。(a) NC组和ACR组移植皮肤的形态变化;(b) NC组和ACR组移植皮切片的H&E染色和CD3抗体免疫组化;(c) 用FITC标记的CD3抗体和纳米流式细胞仪检测EVs的CD3阳性率;(d) 探针间距分别为10、16和20 nm的Au-Caliper分离得到的TCR-CD3单体EVs和二聚体EVs的CD3荧光分布;(e) NTA检测NC和ACR样品中TCR-CD3单体EVs和二聚体EVs的平均粒径。
相关研究成果以“Isolation of Structurally Heterogeneous TCR-CD3 Extracellular Vesicle Subpopulations Using Caliper Strategy”发表于国际知名学术期刊Angewandte Chemie International Edition(DOI:10.1002/anie.202300954)。我院殷文博士和中山大学附属第三医院陈海填博士后为本论文的共同第一作者,我院戴宗教授、柳思扬副研究员和中山大学附属第三医院的郑俊博士为本论文的共同通讯作者,中山大学生物医学工程学院为第一单位。

